Lý thuyết Hóa 11: Bài 4. Phản ứng trao đổi ion trong dung dịch các chất điện li | Myphamthucuc.vn
Lý thuyết Hóa 11 Bài 4. Phản ứng trao đổi ion trong dung dịch các chất điện li

I. ĐIỀU KIỆN XẢY RA PHẢN ỨNG TRAOĐỔI ION TRONG DUNG DỊCH CÁC CHẤT ĐIỆN LI
1.Phản ứng tạo thành chất kết tủa
– Thí nghiệm:

– Giải thích: Na2SO4 và BaCl2 đều dễ tan và phân li mạnh trong nước:
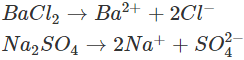
Trong số bốn ion được phân li ra chỉ có các ion ![]() kết hợp được với nhau tạo thành chất kết tủa là BaSO4 (hình trên), nên thực chất phản ứng trong dung dịch là:
kết hợp được với nhau tạo thành chất kết tủa là BaSO4 (hình trên), nên thực chất phản ứng trong dung dịch là:
![]()
Phương trình (2) được gọi là phương trình ion rút gọn của phản ứng (1).
Phương trình ion rút gọn cho biết bản chất của phản ứng trong dung dịch các chất điện li.
2.Phản ứng tạo thành chất điện li yếu
a) Phản ứng tạo thành nước
– Thí nghiệm:

Phản ứng như sau:
HCl + NaOH → NaCl + H2O
– Giải thích: NaOH và HCl đều dễ tan và phân li mạnh trong nước:
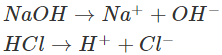
Các ion OH−trong dung dịch làm cho phenolphtalein chuyển sang màu hồng. Khi cho dung dịch HCl vào, các ion H+ của HCl sẽ phản ứng với các ion OH− của NaOH tạo thành chất điện li rất yếu là H2O. Phương trình ion rút gọn:
![]()
Khi màu của dung dịch trong cốc mất, đó là lúc các ion H+ của HCl đã phản ứng hết với các ion OH− của NaOH.
Phản ứng giữa dung dịch axit và hiđroxit có tính bazơ rất dễ xảy ra vì tạo thành chất điện li rất yếu là H2O. Mg(OH)2 ít tan trong nước, nhưng dễ dàng tan trong dung dịch axit mạnh:
![]()
b)Phản ứng tạo thành axit yếu
– Thí nghiệm: Nhỏ dung dịch HCl vào ống nghiệm đựng dung dịch CH3COONa , axit yếu CH3COOH sẽ tạo thành:
![]()
– Giải thích: HCl và CH3COONa là các chất dễ tan và phân li mạnh:
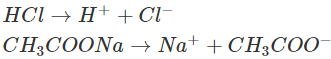
Trong dung dịch, các ion H+ sẽ kết hợp với các ion CH3COO– tạo thành chất điện li yếu là CH3COOH (mùi giấm). Phương trình ion rút gọn:
![]()
3. Phản ứng tạo thành chất khí
Thí nghiệm:

Phương trình ion rút gọn: ![]()
Phản ứng giữa muối cacbonat và dung dịch axit rất dễ xảy ra vì vừa tạo thành chất điện li rất yếu là H2O, vừa tạo ra chất khí CO2 tách khỏi môi trường phản ứng. Chẳng hạn, các muối cacbonat ít tan trong nước nhưng tan dễ dàng trong các dung dịch axit. Đá vôi (CaCO3) tan rất dễ trong dung dịch HCl:
![]()
II. KẾT LUẬN
1.Phản ứng xảy ra trong dung dịch các chất điện li là phản ứng giữa các ion.
2.Phản ứng trao đổi ion trong dung dịch các chất điện li chỉ xảy ra khi các ion kết hợp được với nhau tạo thành ít nhất một trong các chất sau:
_ chất kết tủa.
_ chất điện li yếu.
_ chất khí.
Xem thêm Giải Hóa 11: Bài 4. Phản ứng trao đổi ion trong dung dịch các chất điện li