Báo cáo thực hành + Bản tường trình Hóa 8 Bài thực hành 7 | Myphamthucuc.vn
Nội dung bài viết
Bài thực hành số 7: Pha chế dung địch theo nồng độ
Nội dung bài 45 bài thực hành 7 pha chế dung dịch theo nồng độ chương 6 hóa học lớp 8. Giúp các bạn biết cách tính toán dựa vào nồng độ dung dịch và nồng độ mol, cách pha chế một dung dịch theo nồng độ cho trước và pha loãng một dung dịch theo nồng độ cho trước với các dụng cụ cần thiết.
I. Pha chế dung dịch theo nồng độ
Hãy tính toán và pha chế các dung dịch sau:
1. 50g dung dịch đường có nồng độ 15%.
2. 100ml dung dịch natri clorua có nồng độ 0,2M
3. 50g dung dịch đường 5% từ dung dịch đường có nồng độ 15% ở trên.
4. 50ml dung dịch natri clorua có nồng độ 0,1M từ dung dịch natri clorua có nồng độ 0,2M ở trên.
Hướng dẫn:
1. Thực hành 1
Hãy tính toán và pha chế 50 gam dung dịch đường có nồng độ 15%.
– Phần tính toán:
Khối lượng chất tan (đường) cần dùng là:
![]()
Khối lượng nước cần dùng là:
![]()
– Phần thực hành:
Cân 7,5g đường khan cho vào cốc có dung tích 100ml, khuấy đều với 42,5g nước, được dung dịch đường 15%.
(Em nào thắc mắc về con số 92,500 ghi ở cân thì quay lại xem cách cân dung dịch chất lỏng ở bài Pha chế dung dịch nhé).
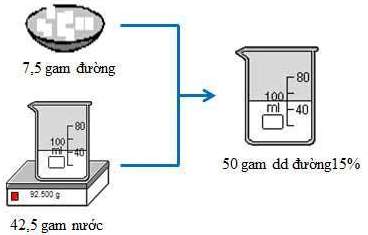
Hình 1: Quá trình pha chế 50 gam dung dịch đường 15%
2. Thực hành 2
Hãy tính toán và pha chế dung dịch Natri clorua (NaCl) có nồng độ 0,2M
– Phần tính toán:
Số mol chất tan (NaCl) cần dùng là:
![]()
Khối lượng BaCl cần dùng là:
![]()
– Phần thực hành:
Cân 1,17g NaCl khan cho vào cốc chia độ. Rót từ từ nước vào cốc và khuấy đều cho đến vạch 100ml, được 100ml dung dịch NaCl 0,2M.
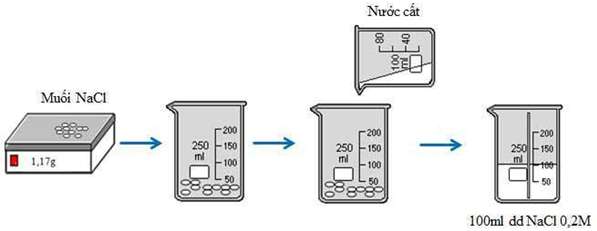
Hình 2: Quá trình pha chế 100ml dung dịch NaCl 0,2M
3. Thực hành 3
Hãy tính toán và pha chế dung dịch 50g dung dịch đường 5% từ dung dịch đường có nồng độ 15% ở phần thực hành 1.
– Phần tính toán:
Khối lượng chất tan (đường) có trong 50g dung dịch đường 5% là:
![]()
Khối lượng dung dịch đường 15% có chứa 2,5g đường là:
![]()
Khối lượng nước cần dùng là:
![]()
– Phần thực hành:
Cân 16,7g dung dịch đường 15% cho vào cốc có dung tích 100ml. Thêm 33,3g nước (hoặc 33,3ml) vào cốc, khuấy đều, được 50g dung dịch đường 5%.
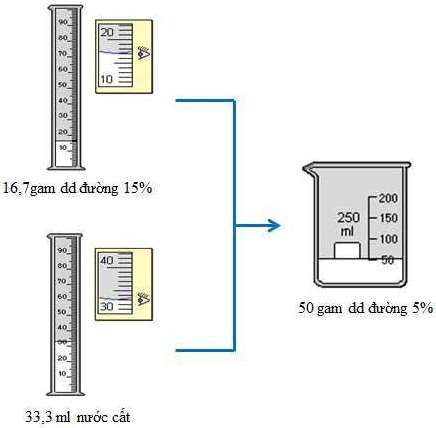
Hình 3: Quá trình pha chế 50 gam dung dịch đường 5%
Lưu ý: Lấy dung dịch có thể sử dụng cân phân tích hoặc dùng ống đong để lấy lượng thể tích mong muốn.
4. Thực hành 4
Hãy tính toán và pha chế dung dịch 50ml dung dịch NaCl có nồng độ 0,1M từ dung dịch NaCl có nồng độ 0,2M ở thực hành 2.
– Phần tính toán:
+ Số mol chất tan (NaCl) có trong 50ml dung dịch 0,1M cần pha chế là:
![]()
+ Thể tích dung dịch NaCl 0,2M trong đó có chứa 0,005mol NaCl là:
![]()
– Phần thực hành:
Đong 25ml dung dịch NaCl 0,2M cho vào cốc chia độ. Rót từ từ nước vào cốc đến vạch 50ml. Khuấy đều, được 50ml dung dịch NaCl 0,1M
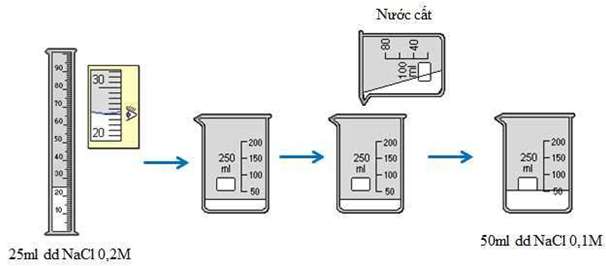
Hình 4: Quá trình pha chế 50ml dung dịch NaCl 0,1M
II. Tường trình thực hành Pha chế dung đích theo nồng độ.
* Một số quy tắc an toàn
1. Khi làm thí nghiệm hóa học, phải tuyệt đối tuân theo các quy tắc an toàn trong phòng thí nghiệm và sự hướng dẫn của thầy cô giáo.
2. Khi làm thí nghiệm cần trật tự, gọn gàng, cẩn thận, thực hiện thí nghiệm theo đúng trình tự quy định.
3. Tuyệt đối không làm đổ vỡ, không để hóa chất bắn vào người và quần áo. Đèn cồn dùng xong cần đậy nắp để tắt lửa.
4. Sau khi làm thí nghiệm thực hành phải rửa dụng cụ thí nghiệm, vệ sinh phòng thí nghiệm.
* Cách sử dụng hóa chất
1. Hóa chất trong phòng thí nghiệm thường đựng trong lọ có nút đậy kín, phía ngoài có dán nhãn ghi tên hóa chất. Nếu hóa chất có tính độc hại, trên nhãn có ghi chú riêng.
2. Không dùng tay trực tiếp cần hóa chất
– Không đổ hóa chất này vào hóa chất khác (ngoài chỉ dẫn).
– Hóa chất dùng xong nếu còn thừa, không được đổ trở lại bình chứa.
3. Không dùng hóa chất đựng trong những lọ không có nhãn ghi rõ tên hóa chất. Không nếm hoặc ngửi trực tiếp hóa chất.
III. Một số dụng cụ thí nghiệm thực hành Pha chế dung đích theo nồng độ.
Phụ Lục 2: Bảng Tính Tan Trong Nước Của Các Axit – Bazơ – Muối
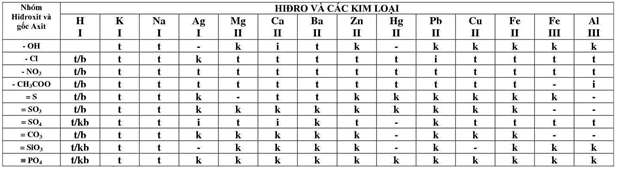
Ghi chú:
t: hợp chất tan được trong nước
k: hợp chất không tan
i: hợp chất ít tan
b: hợp chất bay hơi hoặc dễ phân hủy thành khí bay lên
kb: hợp chất không bay hơi
“-“: hợp chất không tồn tại hoặc bị phân hủy trong nước
Trên là báo cáo bài 45 bài thực hành 7 pha chế dung dịch theo nồng độ chương 6 hóa học lớp 8. Củng cố và hệ thống hóa các kiến thức về thành phần của nước, giúp bạn biết và hiểu định nghĩa công thức tên gọi phân loại các axit, bazơ, muối, oxit.